向盛有氣體NO2的集氣瓶中通入SO2氣體(必修)
更新時(shí)間:2023-04-11 17:04:41作者:佚名
初級(jí)小學(xué)課本物理(選修)第一冊(cè)強(qiáng)調(diào):“三氧化硫是一種沒有色調(diào)易揮發(fā)的晶體,沸點(diǎn)16.8℃,熔點(diǎn)44.8℃。”對(duì)此,師生們往往倍感十分苦惱。倘若三氧化硫的沸點(diǎn)高于室溫(18℃~25℃),在室溫下三氧化硫應(yīng)是無色的液體而不是晶體。如同沸點(diǎn)為10.2℃的純氫氟酸在室溫下稱之為無色的液體而不是無色的晶體一樣。這么,為何用書上仍強(qiáng)調(diào)三氧化硫?yàn)榫w呢?筆者欲從試驗(yàn)和理論兩方面談點(diǎn)粗略的想法,與同行們定奪。向盛有NO2二氧化碳的集鋼瓶圓通入SO2二氧化碳,瓶內(nèi)紅褐色逐步變淺,最后散去;集鋼瓶的內(nèi)壁上附有無色的固體。經(jīng)檢測該固體為室溫狀態(tài)下的三氧化硫。由于NO2具備很強(qiáng)的氧化性,室溫下可將SO2氧化為SO3。即:NO2+SO2=NO+SO3為何三氧化硫在室溫下既不是二氧化碳三氧化硫的物理性質(zhì),也不是液體,而是固體呢?要解決這個(gè)問題首先應(yīng)當(dāng)厘清楚三氧化硫的結(jié)構(gòu)。
此主題相關(guān)圖片如下:
三氧化硫只有在氣態(tài)時(shí)才是單分子,即單個(gè)的SO3單元。三氧化硫分子呈平面三角形結(jié)構(gòu)(如圖1)。硫原子以SP2氫鍵軌道分別跟三個(gè)氧原

此主題相關(guān)圖片如下:

具備氫鍵特性。三氧化硫的共振結(jié)構(gòu)為:
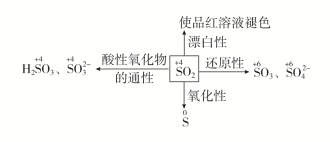
此主題相關(guān)圖片如下:

在固態(tài)時(shí),三氧化硫起碼有三種晶型變體。其中α-SO3為冰狀結(jié)構(gòu)的晶體,以三聚體(SO3)3存在。其硬度16.8℃,熔點(diǎn)44.8℃。三聚體(SO3)3中硫原子是SP3氫鍵的,三個(gè)硫原子通過氧原子以單鍵連締結(jié)環(huán)型,在空間以SO4配體為立方體構(gòu)成S3O9分子環(huán)。其分子結(jié)構(gòu)如圖3。

此主題相關(guān)圖片如下:
β—SO3為石棉結(jié)構(gòu)的多聚體(SO3)n,硬度為32.5℃。它是具備共用氧原子的SO4配體為立方體構(gòu)成的無限長支鏈結(jié)構(gòu)。其分子結(jié)構(gòu)如圖4。
此主題相關(guān)圖片如下:
γ—SO3呈膠體狀態(tài),硬度62.6℃,其結(jié)構(gòu)有待于深入研究。在液態(tài)時(shí),三氧化硫的單個(gè)分子和三聚體處于平衡狀態(tài):3SO3(SO3)3,同時(shí)也存在著多聚體三氧化硫。增加體溫,三聚體則增多,在有痕量水存在時(shí),則產(chǎn)生更多的多聚體三氧化硫而使三氧化硫的狀態(tài)將發(fā)生改變。綜觀三氧化硫的結(jié)構(gòu)、性質(zhì)及狀態(tài),很雖然,在室溫下,α—SO3為無色的液體,在16.8℃時(shí)融化為冰狀的晶體。β—SO3和γ—SO3在室溫下為固體。因?yàn)棣痢猄O3很不穩(wěn)定,經(jīng)放置,非常e799bee5baa6e79fa5e98193e78988e69d83334是在有痕量水存在時(shí),即轉(zhuǎn)變?yōu)棣隆猄O3晶體。因而,三氧化硫常常不能以單純的某一晶型存在,而是由這三種晶型共存的混和晶型。并且三氧化硫在室溫下既不是二氧化碳,也不是液體,而是固體。事實(shí)上,大學(xué)用書上所說的三氧化硫的硬度16.8℃三氧化硫的物理性質(zhì),熔點(diǎn)44.8℃指的是α—SO3的熔、沸點(diǎn)。望采納
- 000-200分上什么大學(xué)
- 200-250分上什么大學(xué)
- 250-300分上什么大學(xué)
- 300-325分上什么大學(xué)
- 大學(xué)排名
- 325-350分上什么大學(xué)
- 350-375分上什么大學(xué)
- 375-400分上什么大學(xué)
- 400-425分上什么大學(xué)
- 本科排名
- 425-450分上什么大學(xué)
- 450-475分上什么大學(xué)
- 475-500分上什么大學(xué)
- 500-525分上什么大學(xué)
- 一本文科
- 525-550分上什么大學(xué)
- 550-575分上什么大學(xué)
- 575-600分上什么大學(xué)
- 600-650分上什么大學(xué)
- 一本理科
相關(guān)文章
為您推薦
宜城教育資源網(wǎng)三氧化硫結(jié)構(gòu)示意圖--發(fā)煙硫酸的實(shí)驗(yàn)室制備方法
2023-04-11 20:04
春秋戰(zhàn)國的社會(huì)呈現(xiàn)了怎樣的特點(diǎn)時(shí)期的時(shí)代特征時(shí)期
2023-04-11 09:01